通知公告
Jungnam Cho 研究团队揭示转座子调控新机制,细胞平台提供相分离成像支持
2021-03-10
2021年3月1日,Nature Plants在线发表了中国科学院分子植物科学卓越创新中心,中国科学院-英国约翰英纳斯中心植物和微生物科学联合研究中心Jungnam Cho研究组题为“Ribosome stalling and SGS3 phase separation prime the epigenetic silencing of transposons”的研究论文,该研究从一个全新的角度阐述了宿主识别细胞中活跃转座子并诱导其沉默的机制,发现SGS3通过其朊蛋白样结构域在体内外均表现出了相分离现象,显示了液-液相分离在siRNA小体形成中发挥关键作用。其中,在证明SGS3蛋白存在相分离现象及SGS3/RDR6等关键蛋白定位的成像实验中,细胞结构分析技术平台因提供技术支持而获致谢。
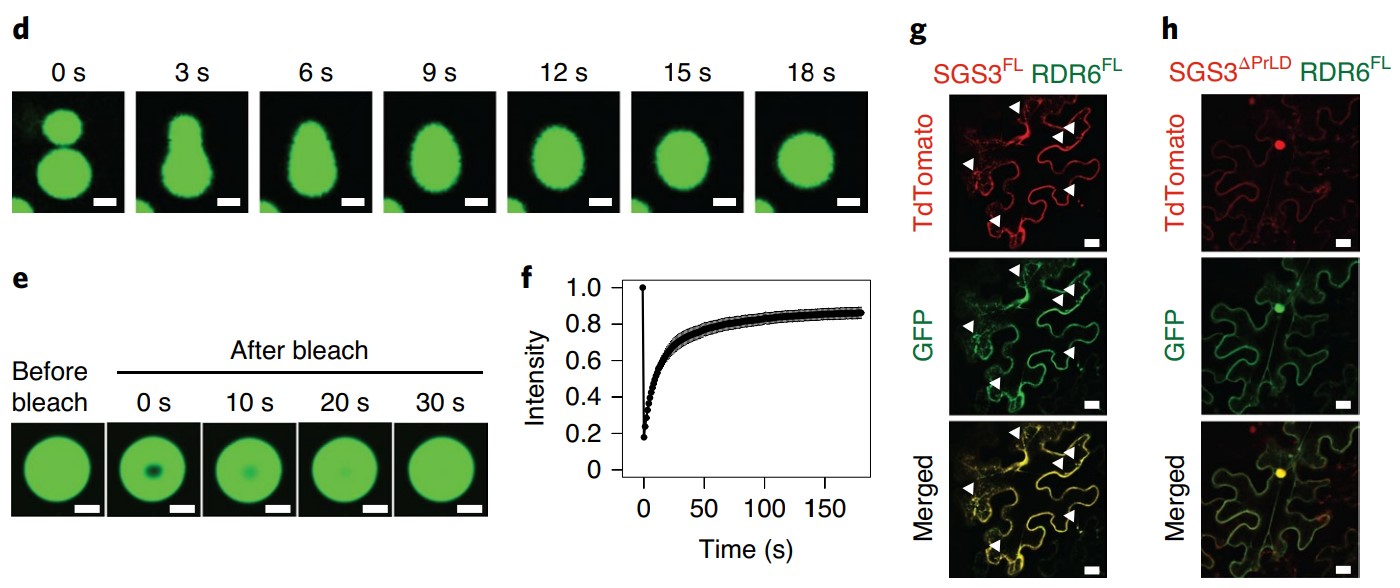
证明相分离的典型实验:体外液-液相融合和荧光漂白后恢复实验(FRAP)(Fig d,e,f)
论文链接:https://dx.doi.org/10.1038/s41477-021-00867-4
关于相分离研究方法的编外:
自2009年德国马普所Clifford P. Brangwynne和Anthony A. Hyman教授在线虫生殖细胞中发现P granule “液-液相分离(LLPS,Liquid-Liquid Phase Separation)“的现象以来,相分离为研究者们在各个领域的机制探索提供了全新的思路,CNS上不断涌现相关的研究论文,植物应用领域同样受益。如何证明目标蛋白是否存在液态相分离现象,在该研究领域也逐渐有了相关实验指南和标准(参考文献),目前来说有以下几个标准:
1. 体外纯化蛋白可以出现液滴融合现象(典型如上图Fig d所示)
2. 结构大小是否达到微米级别(Fig d中标尺为2um)
3. 荧光漂白后恢复实验(FRAP),观察目的蛋白在漂白后是否能恢复荧光,同时提供荧光恢复的定量数据(Fig e,f)
4. 在体细胞内观察到液相分离现象或相关蛋白的共定位等(Fig g)
(以上总结未必完整,但基本是证明相分离存在的必须证据)
细胞结构分析技术平台的激光扫描共聚焦显微镜(Zeiss LSM880及Leica SP8)和转盘共聚焦显微镜(Andor Spinning Disk),通过缩时成像和荧光漂白可以完成上述所列实验。不同的目标蛋白会存在液滴融合速度、荧光漂白条件和荧光恢复速度的差异,通过调整成像参数,摸索合适的条件,一般都可以达到实验目的。研究组如希望进行相关实验协助及后期数据分析,均可联系细胞结构分析技术平台(54924211或wjcai@cemps.ac.cn)。
参考文献:S. Alberti, A. Gladfelter, T. Mittag, Considerations and Challenges in Studying Liquid-Liquid Phase Separation and Biomolecular Condensates. Cell 176, 419–434 (2019).